25 Nov 仿制药的安全监管障碍
生物制品(BP)或生物制剂,是指由不同天然物质(哺乳动物,昆虫和植物的细胞培养物,酵母等)制成的多样化的医疗制品。这些医疗制品被用于防治疾病及医学诊断[1, 5]。 生物制品自从被引入药品市场以来,对许多治疗领域的治疗方案进行了变革,例如肿瘤学[2],皮肤病学,风湿病学等等,对类风湿关节炎,僵直性脊柱炎,克罗恩病,溃疡性结肠炎以及银屑病的病人对抗病症[5]。 尽管这些多样的产品会根据不同的依据,例如,根据产品特点-来源(植物,哺乳动物,细菌等等),说明(抗风湿药,抗银屑病等等)及分子大小进行归类,如果根据后面的参数分类,最显著的之一是单克隆抗体(mAb),不只因为高分子量和结构复杂性。虽然单株抗体[mAb]中带来相对较新的药物种类专利保护,但是他们中的一些已经过期,(例如阿达木单抗,阿昔单抗,贝伐单抗,依那西普单抗,英夫利昔单抗,奥马珠单抗,力妥昔单抗)[4],或即将期满,为后续生物制剂生产提供了大量的机遇(他们更多的被成为“仿制药”)[3].。
仿制药是原药品的“复制品”,他们只是相似,并不相同。其中差异可以被理解为无法准确的去复制原药品的生产过程,很明显这是由于原药品开发者公布的有用信息太少,反向研发的必然性,对原药品和仿制药对比,分子复杂性和其他一些因素缺乏可靠的分析方法。不幸的是,要提高后续仿制药和原药品的相似程度和改变现状看起来非常困难, 不仅仅是因为上述原因,更因为法规要求的多变性。
一大批国家已经制定了仿制药批准总则。然而,至今为止,在仿制药的临床及药物上市后监管法规上,各国要求则不尽相同,有时相当模糊不清(见表格1)。

考虑到mAb代表市场上结构最复杂和大量的生物制剂之一,研制相关问题的描述对产品质量(纯度,均匀性等)有很大影响[5]。 因此,为了确保这类产品的安全性和有效性,需要更加完备的药物警戒计划以及更详细的临床前和临床阶段期间的研究。
然而,在21世纪的第二个十年期间,EMA已经发表了单独的“含有单克隆抗体的类似生物医药产品–非临床和临床问题的指南”和批准用于单克隆抗体药物的生物仿制药。 这些行为强调了对这些药物做出快速决定的高度重要性,这对于随后的全球规范更新提出了明确的要求:
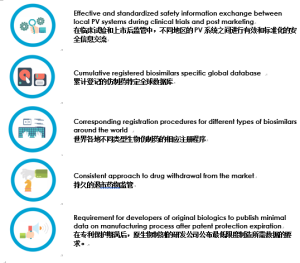
考虑到生物制剂界讨论和加强信息交流全球化的趋势,我们期待改进欧洲的经验,(如EMA / WHO仿制药指南)并转化到所有其他国家,以增强mAb和其他仿制药的相似性,安全性和有效性。
全文请点击仿制药的安全监管障碍



